 |
 |
- Search
| Asian J Kinesiol > Volume 24(2); 2022 > Article |
|
Abstract
OBJECTIVES
The purpose of this study was to investigate the effects of moderate downhill running exercise on glucose tolerance and skeletal muscle phospho-AMP activated protein kinase(P-AMPK) expression in type ã
À diabetes rats.
METHODS
8-week-old, 24 wistar & GK rats (type ã
À diabetes model) were randomly divided into 4 groups, NR, NE, DR, DE. Downhill running treatment were performed on the treadmill at the -16 % and speed of 16m/min for 1 hour. All groups were done with Oral glucose tolerance test(OGTT) and after 1 week washout period, rats in exercise groups performed downhill running. After exercise treatment, soleus muscle of rats were extracted for test of P-AMPK expression.
RESULTS
In OGTT, blood glucose levels in all groups were increased after the oral glucose load and these were significantly differ from rest level. But in DE group, blood glucose level at 120 min after OGTT was not significantly differ from rest level. In immunoblotting test for P-AMPK expression of skeletal muscle, NE group was significantly higher than NR group and DE group was significantly higher than other groups.
š 2Ú Š¿Š´Š š¡šŠÎ¯ õ¡¯ŠË šËš š¡ š¡šŠÎ¯ š ÚÙšÝ(insulin resistance)š¥ŠÀ š¡ÚÇ Š¯šÚŠˋ¯[1], šÇ šÏÚš ššÇ Š¯Š°çš š¡ õñ¥ššÑ ÚŠš š¡šŠÎ¯Š₤¥õ¯ŠŠË¥ Šš¥ Š¢ŠÏ šŠŠ¥ šÇ õ¡¯š š õý§ŠÀš ŠÊŠË¡ Š
šš õý§ŠÀŠË¥ ÚçÚÇšŠ šÀ¯šÏš Ú˜ŠŠ¿ ÚÀšŠË¥ šÎõ¯šš¥ õ° ÚŠ¿ šÎšš šÚšÚ´ŠÊ [2-4].
Š¿Š´ ÚšŠÊšš š šýÇÚŠšÇ Ú˜ŠŠ¿ ÚÀšŠË¥ šÎõ¯šÚÊŠ õ¡¯š š šÇŠš šÚÇ õ°´õýˋõñ¥ ŠÇ Š¿ššÀšýÇš ÚŠš¡ GLUT-4 Š´Š¯ÝšÏš Š¯Úõ°¥ š šõ¯ šÎõ¯Ú´š¥ŠÀš´ õ¡ŠÈ´š§šÊš š¡Ú˜ŠÏ šÇŠõ°¥ Ú˜õ°¥šÝš ŠšÇõ¡¯ ŠŠ˜¡šÇŠÊ[5-8]. ŠˆŠˆ š¯õ瘚š šñšË öýš¡Ú˜ õ¡¯ŠËšÇ ššŠ šÊښˊ˥ Ššš¥ŠÀ šÇŠš šÊšÚ õý¯õ°¥, š¡šŠÎ¯ ŠÑŠ¿š Š˜ÇõÇÚõý õ°´õýˋõñ¥ ŠÇ GLUT-4š Š¯ÚšÇ Úš Úõý šÎõ¯Ú´š Š°Çõ° ÚšŠÊ[9-11].
šÇŠ šÊ õñ¥ššÑš õ¡ŠÈ´š§šÊ ÚÀšš õÇŠ ´Ú ŠÊšÚ Š´Š¯ÝšÏ šÊ AMP activated protein kinase(AMPK)š ښݚ šÎõ¯šÚÊŠ Š¯ Ú˜õý õ¡¯š˜ÚŠÊ. AMPKŠ õñ¥ššÑ šŠšÏš¡ creatine phosphate, ATP õ¯šš šÚÇ ÚšÝÚŠŠ šŠšÏ õ¯šÏõ¡¯(sensor)ŠÀš, š¡Ú˜ŠÇ šÊÚ¡Š šÊ šÚˋšš õñ¥šÀš¥ŠÀš Ú˜ŠŠ¿ ššÀõ°¥ šÏŠ¯ˋš¯ š¯ÚŠË¥ šõñ¿ÚŠ õýš¥ŠÀ šŠ Êš ¡ šŠÊ[12]. ŠˆŠˆ š¯õ瘊ʚš šÇŠ Ú õ°´õýˋõñ¥ GLUT-4 Š¯Úõ°¥ š šõ¯ AMPK ÚšÝ šÎõ¯š šÚÇ š ŠŠ´š šš˜Ú Š¯ šŠÊ[13-15].
ÚÚ¡, š¥šš š¥ŠÀ ÚÚš˜šÏŠ š šýÇÚŠš ŠÊšÚ Š¯ˋŠýš¥ŠÀ šÇŠÈ´šÇšÏŠŠ¯, šÇŠš õñ¥ššÑ ÚÚ ŠÚ ŠÊšÚŠÊ. š¥Š¯š š¥ŠÀ ښϚšš õÝñõ¡¯, Š˜ŠÎ˜õ¡¯š õ¯š š š¯š šÇŠ š õñ¥ššÑš õ瘚˜šÝ ššÑ(concentric contraction)õ°¥ šš˜šÝ ššÑ(eccentric contraction)š¥ŠÀ õ瘚݊ŠŠ¯, õ瘚˜šÝ õñ¥ššÑšÇ ŠÏš ŠÑŠÑš š¯´šÏÚŠÊ. õñ¡Š šÏŠÏ, š¥ššÚ šÊšŠ ŠÇŠÎ˜ŠÏ õÝñõ¡¯š Š˜ŠÎ˜õ¡¯ ŠŠ õ°Š´ ŠÇŠ Êõ¯õ¡¯ ŠÝõ°¥ õ¯š šš˜šÝ õñ¥ššÑ ÚÚ ŠÚ Š¿ŠýÚõý Š¯šÚŠÊ.
ŠˆŠˆ š¯õ瘚š ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ŠË¥ šÊšÚšš Š š¡šŠÎ¯ š ÚÙšÝšÇ 48šõ¯ Šš šÏšŠŠ õýš¥ŠÀ Š°Çõ° ŠšŠŠ¯[16-18], õñ¡ šš¡š¥ŠÀ Š¯Š°çš š¡ šš˜šÝ ššÑš¥ŠÀ š¡Ú õñ¥š¡Ú˜ šššÇ Š´Úçš¡Ú˜ŠÀŠÑÚ¯ šÎõ¯Š tumour necrosis factor-öÝ(TNF-öÝ)š ŠÑŠ¿ šÎõ¯š šÇŠÀ š¡Ú IRS-1 š¡š¯Úš PI3Kš ښ݊ŠË¥ ŠÛšÑÊš¥ŠÀš´ š¡šŠÎ¯ š Ú¡ š Š˜š šçš šÚ´ŠÊõ° ÚšŠÊ[19].
Š¿Š´ šÎš õ¯š š šÚ šÇŠ Ú´õ°¥š õÇÚÇ õñ¡Šš ŠÏš š¯õç˜ŠÊšÇ šÇŠÈ´šÇš ¡ šõ° , ŠšýÇŠÀ šÊŠÝŠš õ¯Šš šÇŠšÇ õ¡š š Ú´õ°¥ŠË¥ šÊŠÊŠ õýšÇ š¥š¿Š õý¯ŠÀ šÇšŠÊ. ښϊÏ, š 2Ú Š¿Š´ Šˆ´Š¡šš šš˜šÝ õñ¥ššÑ šÇŠšÇ Š¿ŠÇšÝõ°¥ õ¡ŠÈ´š§šÊ ÚÀšš õÇš˜ÚŠ AMPK Š´Š¯ÝšÏ ښݚ šÇŠ Ú šÚËš šÈ¥ŠšÏš õÇÚ š¯õ瘊ʚ õݯš ššš¥Šˋ¯, Š¯Š¥š šÇŠË¥ õýšÎÚ ÚššÝšÇ š õ¡¯ŠšŠÊ.
Š¯Š¥š Š°¡ š¯õ瘊 š 2Ú Š¿Š´ šËš ŠÚ š¥ÚšÝ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠ šýš¿õ¯ Š¿ŠÇšÝõ°¥ õ°´õýˋõñ¥ AMPK š¡š¯Ú(phosphorylation)š šÇŠ Ú šÚËš Š₤¡š¿Š šÏŠË¥ ššŠ°Çõ° š ÚŠÊ.
Š°¡ š¯õ瘚 šÊÚŠŠ˜¥š š 2Ú Š¿Š´ Šˆ´Š¡(SLC Inc. Japan)š¡ Goto-Kakizaki(GK) rat(age=8 weeks, weight=190.5ôÝ20.8 g, n=12)š ŠšÀ¯õ篚¥ŠÀ Wistar rat(age=8 weeks, weight=244.8ôÝ13.9 g, n=12) 24ŠÏŠÎ˜ŠË¥ ŠÑšŠ¯š õ¯õ¯ š šÚÇšõç¯(Normal Rest;NR, n=6), š ššÇŠõç¯(Normal Exercise;NE, n=6), Š¿Š´ÚÇšõç¯(Diabetes Rest;DR, n=6), Š¿Š´šÇŠõç¯(Diabetes Exercise;DE, n=6)š¥ŠÀ Š˜Çš Ú Š¿ Š¯ Š¯¯š Úš˜ šÊÚ š š¥šÈ¥š¥ Šš šÊÚšÊ Úõý§š š ššš¥¯ŠÊ. šÊÚŠŠ˜¥š šÊÚŠŠ˜¥šˋ š¥šÇšÏŠË¥ šÇšˋÚš˜ š˜šÀÚšš¥Šˋ¯, š˜šÀšÊš š´ŠŠ 22-24ã, šçŠŠ 50ôÝ10%õ¯ š šÏŠŠŠÀ ÚšŠÊ. šÊÚŠŠ˜¥š šÚŠŠ õ° Ú š˜ŠÈ(š¥šš˜, ÚõçÙ)š Š˜¥š šš ŠÀÙõý šÙšñ´ÚŠŠÀ Úšõ° , šÇŠšýš¿ 12šõ¯ š š š˜ŠÈŠË¥ Šˆ´Š š õݯښŠÊ. šÀ¯Šˆ
š šÊÚŠŠ˜¥š š¥ÚšÝš õ° Š ÊÚš˜ Š¯ÊŠÛ šÈ¥õ¡¯(12šõ¯ šÈ¥/š¥)õ¯ šÀ¯š ŠŠŠÀ ÚšŠÊ.
šÇŠõ篚 šËŠÊš šÚŠŠ˜¥šˋ Ú¡Š ŠŠ¯š šÇšˋÚŠˋ¯ 0% õý§š˜Ššš 5m/min šŠŠÀ š¥š¥ 10ŠÑ Šš, 3š¥õ¯š š š ÚŠ ´š šÊšÚšŠÊ. šÇŠšýš¿ Š¿š¥ 12šõ¯ õ°çŠ°ç šÚšš -16 % õý§š˜Ššš 16m/min šŠŠÀ 1šõ¯ Šš šš˜šÝ õñ¥ššÑš š Š¯šÚÊŠ š¥ÚšÝ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠš šÊšÚšõ° , ÚÇšõ篚 šËŠÊš õ¯š šõ¯Šš Ú¡Š ŠŠ¯šš ÚÇšÚŠŠÀ ÚšŠÊ. šÇŠõ¯ŠŠ šÊÚ ŠŠ˜¥ šÇŠõ¯Š šÊš Š¯ˋŠýš Š¯Š¥ š§ VO2max 60-65% š Šš šÊõ¯Š šÇŠšÇšŠÊ[20].
šÊښ˚ šÇŠ šýš¿õ¯ ŠŠ Ú 1šõ¯šÏ¡š õý§õç˜ Š¿ŠÑÚ õýš˜(Oral Glucose Tolerance Test; OGTT)ŠË¥ šÊšÚšŠÊ. 3š¯´ šÎŠËš 1mlš glucose 0.2mgš Ú¥ÚˋÚš˜ 20% ššÊš glucose šˋšÀš ŠÏŠ Ú, šÊښ˚ õý§õ瘊˥ ÚçÚÇ kgŠ¿ 2ml šÙšñ´šÚ´ Ú õ¥˜ŠÎ˜š ŠÏËš¥ŠÀŠÑÚ¯ 30ŠÑ, 60ŠÑ, 90ŠÑ, 120ŠÑš õ¯õ¯ šÝÚÚš˜ ÚŠ¿ š¡Àš õ¡¯(ACCU-CHEK, Roche Diagnostics, Germany)ŠË¥ šÇšˋÚš˜ š¡Àš ÚšŠÊ. ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠš Š¯ŠË¡ õ°´õýˋõñ¥ P-AMPK Š¯Ú š ŠŠË¥ š¡Àš Úõ¡¯ šÚš˜ OGTT šÊš Ú 1šÈ¥š¥õ¯š wash-out periodsŠË¥ šÈ¥šÇ ŠÊš šÇŠšýš¿ŠË¥ šÊšÚšŠÊ. šÇŠ Ú 1šõ¯šÏ¡š Zoletil 50ãÀ(10 Ð/Ð, im.: Vibac Laboratories, Carros, France)š Š°çõ¯ ŠÇ šÈ¥š˜Úš˜ ŠÏšñ´šš¥¯ŠÊ. õ°´õýˋõñ¥ šÚŠÏš ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯š šÚ õñ¥ššš õ¯šË ŠÏšÇ Š¯Š õ¯šŠ₤¡õñ¥(soleus)ŠË¥ š šÑÚšš¥Šˋ¯(21), šÎš šÀښϚŠÀ Šõý¯šš¥, ŠÑšÚ Šõ¿šÏ -70ãšš Š°ÇõÇÚšŠÊ.
š šÑÚ õñ¥šÀ šÚ 150Ð š ŠŠË¥ š¥š š š ššš šõý š Š´ÚšŠÊ. õñ¥šÀ¯šÏš 137mM Nacl, 2,7mM KCl, 10mM Na2PO4, 2mM KH2PO4(pH 7.4)õ¯ Ú´š Š PBSŠÀ š£š Ú 50-200К triton lysis buffer(20mM Tris, pH 7.4, 137mM NaCl, 25mM öý-blycerophosphate, pH 7.14, 2mM EDTA, 1mM Na3VO4, 1% Triron X-100, 10% glycerol, 5Ð/Ð leupeptin, 5Ð/Ð aprotinin, 3Ð benzamidine, 0.5mM DTT, 1mM PMSF)š ŠÈšÇ šÇšÚ ŠÑÚÇÚšŠÊ. õñ¡ Ú õ¯ sampleš ŠÚ Š´Š¯ÝšÏš š ŠÚŠˋ¯, õñ¡ šÊ 10К Š´Š¯ÝšÏš western analysisš š˜šˋÚšŠÊ. Membrane proteinš 12% SDS-PAGE(1.5M Trizma base, 10% Sodium Dodecyl Sulfate, 30% Acrylamide, 10 Ammonium Sulfate, TEMED) ššš š õ¡¯šŠšÚ´ Ú PVDF membrane(Pall Corporation, USA)š š õ¡¯ šÇŠšš¥¯ŠÊ. Antibodyšš Š¿Ú¿šÇš š¡ õý¯Úˋš ŠÏõ¡¯ šÚÇ 3% BSA, 0.1% Tween 20š Ú´š Úõ° šŠ TBS bufferšš membraneš 1šõ¯ Šš šš´ Š¯ššÚÊõ° 4ãšš 16šõ¯ Šš Š¯ššš¥¯ŠÊ. Š¯ššÇ ŠŠ membraneš washing Ú Ú 1š¯´ ÚÙšýÇš¡ rabbit monoclonal antibody(p-AMPK Thr172, Cell signaling, USA)ŠË¥ Blocking buffer(1X TBS buffer, 3% BSA, 0.1% Tween 20)š 1:1000š Š¿š´ŠÀ Ú˜šÚš˜ šš´šš 30ŠÑ Šš Š¯ššš¥¯ŠÊ. õñ¡ Ú membraneš š£šÇŠÇõ° 2š¯´ ÚÙšýÇš¡ HRP conjugated anti-rabbit IgG(Santa Cruz, USA)ŠË¥ 1:1000š Š¿š´ŠÀ Ú˜šÚš˜ šš´šš 30ŠÑ Šš šýŠÎ˜Úõ° ŠÊš Ú Šý š£šÇŠÇšŠÊ. šÇÚ Membraneš ŠÑš¯ˋŠ Š´Š¯ÝšÏš Western blotting detection systemš šÇšˋÚš˜ š¡Àš Úšš¥Šˋ¯, densitometer (Sharp jx-330)ŠË¥ šÇšˋÚš˜ šÊš¤Ú Ú, šÇŠ₤¡šÏ ŠÑš ÚŠÀõñ¡Š´ (Image Master ver. 3.0, Biotech pharmacia)š ÚçÚÇ P-AMPK Š´Š¯ÝšÏŠš š¯šÑÚšŠÊ.
Š°¡ š¯õ瘚 Ššš ŠÚÇ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠšÇ Š¿ŠÇšÝõ°¥ õ°´õýˋõñ¥š P-AMPK Š¯Úš Š₤¡š¿Š šÚËš ššŠ°Çõ¡¯ šÚÇ Šˆ´Š šÂ
š Š°š¡ŠÊš šÏŠ´Š° Úõñ (M)õ°¥ ÚšÊÚ¡š¯´(SD)ŠË¥ õç˜ÚšŠÊ.
ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠšÇ Š¿ŠÇšÝš Š₤¡š¿Š šÚËš ŠÑšÚõ¡¯ šÚÇ šýš¿šÏŠ´õ°¥ šÝÚšš š Š¯ŠË¡ Š¯Š°çš¡Àš ŠÑš¯ŠÑš(repeated measured ANOVA)ŠË¥ šÊšÚšš¥Šˋ¯, šÚ¡ššˋÚ´õ°¥õ¯ š šÚ õý§š¯ õ¯ šÏŠ´ŠÇ šš Š° š˜ÚŠÑšš ŠŠ¿(contrast) õýšÎš šÚÚšŠÊ. ŠÚ P-AMPK Š¯Ú š ŠŠË¥ ŠÑšÚõ¡¯ šÚš˜ š¥šŠÑš¯ŠÑš(one-way ANOVA)š šÊšÚšš¥Šˋ¯, š˜ÚŠÑšš Tukey HSDŠË¥ šÇšˋÚšŠÊ. š šššÊš .05ŠÀ ÚšŠÊ.
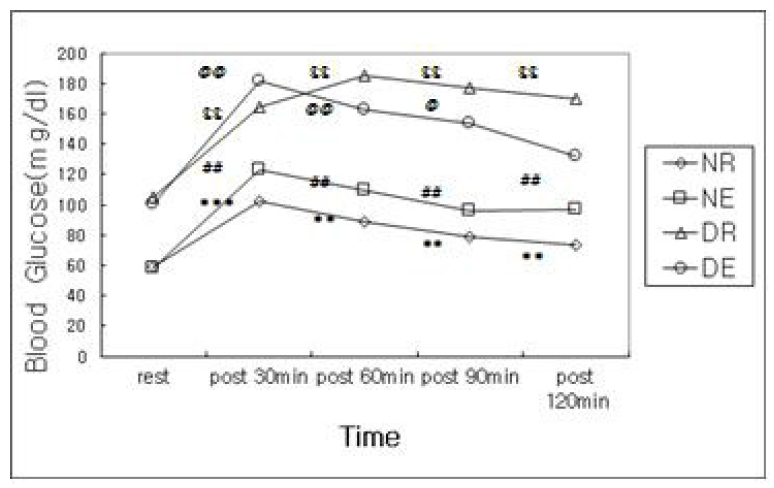
Š°¡ š¯õ瘚š ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠšÇ Š¿ŠÇšÝš Š₤¡š¿Š šÚËš ŠÑšÚõ¡¯ šÚ OGTT õý¯õ°¥š¿š ŠÚš˜ Š¯Š°çš¡Àš ŠÑš¯ŠÑš(repeated measured ANOVA)š šÊšÚ õý¯õ°¥(Table 1, Figure 1), šýš¿šÏŠ´(P< .001), šÝÚšš (P<.001)š šÈ¥Ú´õ°¥ Š¯ šýš¿šÏŠ´õ°¥ šÝÚšš õ¯ šÚ¡ššˋÚ´õ°¥(P< .05)õ¯ š šÚ õýš¥ŠÀ ŠÚŠ˜ŠÊ.
(Fig. 1)šš Š°ÇŠ Š¯š õ¯šÇ, Šˆ´Š šÏŠ´šš šš šš Š¿ÚÇ OGTT õ¯ šš šš š šÚõý Šš ÚŠ¿ ššÊš Š°ÇššÏŠÏ, DE šÏŠ´ššŠÏ OGTT 120ŠÑ šÏ¡š šš šš š šÚ š¯´šÇŠË¥ Š°ÇšÇšÏ ššŠÊ. ŠÚ NR, NE, DE šÏŠ´š õý§š¯, OGTT 30ŠÑ šÏ¡ŠÑÚ¯ õ¯šÚšš¥Š, DR šÏŠ´ššŠ 60ŠÑ šÏ¡ õ¿šÏ šÎõ¯Úšõ° , 120ŠÑ šÏ¡õ¿šÏ Š¿šñÚ ššÊš š šÏÚšŠÊ.
Š°¡ š¯õ瘚š ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠ Ú õ°´õýˋõñ¥ P-AMPK expressionš Š°ÚŠË¥ ššŠ°Çõ¡¯ šÚÇ šÊšÚ š¥šŠÑš¯ŠÑšš õý¯õ°¥(Fig. 2), õñ¡ŠÈ¿õ¯ š šÚ Ú´õ°¥(F=14.057, P=.000)õ¯ ŠÚŠ˜ŠÊ. šÇš ŠÚ š˜ÚŠÑš õý¯õ°¥, NE šÏŠ´š NR šÏŠ´š Š¿ÚÇ š šÚõý Šš ššÊš ŠÚŠÇšõ° , DE šÏŠ´š Šˆ´Š šÏŠ´š Š¿ÚÇ š šÚõý Šš ššÊš ŠÚŠÇšŠÊ.
šÇŠš Š¿Š´ Úšš ÚŠ¿ ššÊš ŠÛšÑ¯ šÎšš õ¯š šÚÊŠŠ¯[4,22-24]. šÇŠ õñ¥ ššÑš Š¯ŠË¡ š¡šŠÎ¯Š₤¥õ¯Šš šÎõ¯š Ú´õ£ šÀ¯šÏ ŠÇ Š¿ššÀšýÇ(GLUT-4)š š¡Ú˜ŠÏ šÇŠ õ¡¯š š ÚçÚ š¡šýÇ šÀ¯šÏš¥ŠÀš Ú˜ŠŠ¿ ÚÀš šÎõ¯š õ¡¯š¡ÚŠÊ. š 2Ú Š¿Š´ Úšš šÎš šÚš ŠÚ šÇŠšÊš˜ š¯õ瘊ʚ õ瘚˜šÝ õñ¥ššÑ ÚÚš šÇŠš šýš¿Ú õýšÇ ŠŠÑŠÑšÇšŠÊ. šÇŠ Š¯ˋŠýš ŠÊšÚõ° š¥ššÚ šÊš š šýÇÚŠ ÚÚ ŠÚ ŠÏÊš¯ ŠÊšÚšÏŠÏ, šš˜šÝ õñ¥ššÑšÇ šÈ¥ŠÀ ŠÚŠŠ ŠÇŠÎ˜ŠÏ šÇŠš Š¯ŠË¡ ÚŠ¿ Š°Úš õÇÚ š¯õ瘊 ŠŠ˜¥ŠÊ.
ŠˆŠˆ š¯õ瘚š õ° õ¯Š ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ŠË¥ šÊšÚ õÝÇõ¯Ú š¥Š¯š¡šõýš šÇŠš š Š¿ÚÇ 48šõ¯ Šš š¡šŠÎ¯ Š₤¥õ¯Šõ¯ ŠÛššÏš Š°Çõ° ÚšŠŠ¯[16,17,25], ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠš õñ¥š˜š õ¯ õ¡¡šÇšÏŠˋÇš ššÑŠŠ ÚÚŠÀš õñ¥šš˜š (myofibril)š ššõ°¥ š¥šÎŠ¯ššÇ ŠÚŠŠˋ¯, šÇŠ Š´Úçš¡Ú˜ŠÀŠÑÚ¯ šÎõ¯Š tumour necrosis factor öÝ(TNF-öÝ)š ŠÑŠ¿ šÎõ¯ŠÀ IRS-1 š¡š¯Úš PI3Kš ښ݊ŠË¥ ŠÛšÑÊš¥ŠÀš´ š¡šŠÎ¯ š Ú¡ š Š˜š šçš šÚ´ŠÊõ° ÚšŠÊ.
Š°¡ š¯õ瘚šŠ 1šõ¯Ššš ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠ Ú Š¿ŠÇšÝ õýš˜ õý¯õ°¥, Šˆ´Š šÏŠ´šš šš šš Š¿ÚÇ õ¯ õýš˜ šš šš š šÚõý Šš ÚŠ¿ ššÊš Š°ÇššÏŠÏ, Š¿Š´ šÇŠ šÏŠ´ššŠ õýš˜ 120ŠÑšÏ¡š ÚŠ¿ ššÊšÇ šš šš š šÚ š¯´šÇŠË¥ Š°ÇšÇšÏ ššõ° , ŠÚ ŠÊŠË¡ šÏŠ´õ°¥ Š˜ŠÎ˜, Š¿Š´ ÚÇšõ篚šŠ 60ŠÑšÏ¡õ¿šÏ šÎõ¯Úšõ° , 120ŠÑšÏ¡õ¿šÏ Š¿šñÚ ššÊš š šÏÚšŠÊ. õý¯õçÙ Š¿Š´ ÚÇšõ篚šŠ Š¿ŠÇšÝšÇ õ¯šÚ Š¯ŠˋÇ, Š¿Š´ šÇŠõ篚šŠ šÇŠš¥ŠÀ Š¿ŠÇšÝ õ¯š Ú´õ°¥ŠË¥ õ¯š ¡š´ õýš¥ŠÀ šõ¯ŠŠÊ.
Š°¡ š¯õç˜ õý¯õ°¥Š šš š¡õ¡Ú šš˜šÝ šÇŠ Ú š¡šŠÎ¯ Š₤¥õ¯Š š ÚŠË¥ Š°ÇšŠÊŠ š Úš¯õ瘊Ê[16,17,25]š õý¯õ°¥š ŠÊŠË¡ ššš¥ŠÀ, šÇõýš šýš¿Ú šÇŠš õ¯Š š¯´šÇš Š¯ŠË¡ õýšÇŠ¥õ° šõ¯ŠŠÊ. Š°¡ š¯õ瘊 Š¿Š´ ŠŠ˜¥Šˆ´Š¡š Ššš¥ŠÀ Ú VO2max 60-65%š šÊõ¯Š šÇŠš¡ Š¯ŠˋÇ, š š Úš¯õ瘊ʚ VO2max 85%š õ° õ¯Š šš˜šÝ šÇŠš šÊšÚšŠÊ. Š¯Š¥š š Úš¯õ瘊ʚš š¡šŠÎ¯ Š₤¥õ¯Šõ¯ š ÚÚ õýš õ° õ¯Š šš˜šÝ šÇŠšÇ õñ¥šÀ šÀ¯šÏš š¥šÎ Š¯šš š¥š¥š¥ š¡šŠÎ¯ š Ú¡šýÇõ°š šÚËš šÈ¥ššÏŠÏ, Š°¡ š¯õ瘊 šš˜šÝ šÇŠšÇŠ¥ ÚŠŠ¥Š šÊõ¯ š Šš šÇŠ õ¯Ššõ¡¯ ŠŠ˜¡š Š¯Š°çš õñ¥ ššÑšÇ Š¿Š´ šËš õñ¥šÀšš õ¡ŠÈ´š§šÊš šÇšˋš õ¡š š š Ú¡ŠÀ ššˋÚšš õýš¥ŠÀ š˜ŠÈŠŠÊ. šÇŠ˜Ú ÚÇšš šš˜š š šÈ¥Š š¯õ瘊À, š¥Š¯š¡š Ššš¥ŠÀ õ¯õ¯ šÊŠËÇŠÏ õÝñõ¡¯š ŠÇŠÎ˜ŠÏ õÝñõ¡¯ŠË¥ šÊšÚ Ú, Š¿ŠÇšÝ õýš˜ŠË¥ šÊšÚš˜ Š šÏŠ´š Š¿õçÚ õý¯õ°¥, Š õ¯šÏ šÇŠšýš¿ Šˆ´Š š š˜Úõý ÚŠ¿ ššÊšÇ õ¯šÚšŠÊõ° Š°Çõ° ÚšŠÊ[26,27]. šÇ š¯õ瘚ŠÊš š 2Ú Š¿Š´Úšš õ¯šÇ Šš˜šÏښNJ š˜ÚõÇšÏÚšÇ šŠ Šššš šýÇŠ Ë ššÊš õ¯šÚŠˋÇ ŠÛš õ¯Šš ŠÇŠÎ˜ŠÏ õÝñõ¡¯š õ¯š šÇŠšÇ šÊŠËÇŠÏ šÇŠš Š¿ÚÇ Š°ÇŠÊ š§õý šËõ¡¯õ¯ Ú´š´š š¥ŠÀ ÚŠÚ š šŠ šÇŠ ÚÚŠ¥õ° ŠÑšÚšŠÊ.
õñ¥šÀšš šŠšÏ õ¯šÏ-š Ú¡š Š˜ (energy sensingsignaling)š šÙÚ š ÚŠ AMPKŠ õñ¥š˜š š ATP õ° õ¯š Š¯ˋšÏÚõ¡¯ šÚ ÚšÚŠ˜¥õ°¥ šÏŠ¯ˋ Šš˜š õÇš˜ÚŠˋ¯[12,28,29], šÇŠš šÀ¯šÏ ŠÇ AMPKš ÚšÝÚŠË¥ ÚçÚÇ š 4Ú Š¿ššÀšýÇ(GLUT-4)ŠË¥ š¡Ú˜ŠÏš¥ŠÀ šÇŠšš¥ Ú˜ŠŠ¿š šÀ¯šÏ ÚÀšŠË¥ šÎõ¯šÚÊŠ õýš¥ŠÀ šŠ Êš ¡ šŠÊ[13].
š 2Ú Š¿Š´ŠË¥ õ¯šÏ Úš ŠŠ ŠŠ˜¥ Šˆ´Š¡š Ššš¥ŠÀ Ú š¯õ瘊Ê[30-32]š Š¯ŠËÇŠˋÇ, š¡šŠÎ¯õ°¥Š Š
ŠÎ§š š¥ŠÀ šÇŠš ÚçÚÇ AMPK ÚšÝÚõ¯ GLUT-4 š¡Ú˜ŠÏ š šŠË¥ šÎõ¯šš¥ õ¡ŠÈ´š§šÊ ÚÀšŠË¥ šÇšÏšÚ´ŠÊõ° Úšš¥Šˋ¯, š¥Š¯š¡õ°¥ š 2Ú Š¿Š´õ篚 š˜šÇÚÇ šÇŠš Š¯ŠË¡ AMPK ښݚ ŠÑšÚ š¯õ瘚š Š šÏŠ´ õ¯ š š˜Úõý ŠÚŠŠÊõ° Š°Çõ° ÚšŠÊ[13].
Š°¡ š¯õ瘚šŠ š 2Ú Š¿Š´ šËŠË¥ Ššš¥ŠÀ š¥ÚšÝ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠšýš¿ŠË¥ Úš Š, õ°´õýˋõñ¥ AMPK ÚšÝÚ ššÊš ŠŠ°ÚÇ šÈ¥Š AMPK š¡š¯Ú š ŠŠË¥ Úõ¯Ú õý¯õ°¥, š š šÇŠ šÏŠ´š š š ÚÇš šÏŠ´š Š¿ÚÇ š šÚõý Šš ššÊš ŠÚŠÇšõ° , Š¿Š´ šÇŠ šÏŠ´š Šˆ´Š šÏŠ´š Š¿ÚÇ š šÚõý Šš ššÊš ŠÚŠš¥ŠÀš´ šÇŠš¥ŠÀ š¡ÚÇ AMPKš ÚšÝšÇ šÎõ¯ÚŠ Úšš Š°ÇšŠÊ. Š°¡ š¯õ瘚 õý¯õ°¥Š šÇŠš šÚ Š¯Š°çš š¡ õñ¥ššÑšÇ AMPK ښݚ šÎõ¯šÚ´ŠÊŠ š Úš¯õ瘊ʚ õý¯õ°¥[30-32]š š¥š¿ÚŠˋ¯, šš˜šÝ õñ¥ššÑšÇ šŠ¯ŠŠ šÊõ¯Šš ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠš šÚÇšŠ AMPKš ÚšÝšÇ šÎõ¯Š š ššš Úš¡ÚšŠÊ.
ÚËÚ Š¿ŠÇšÝ Š°Úš Ú˜ŠŠ¿ ÚÀš õ¡¯š š ŠÚ ŠÇŠÎ˜ŠÏ šÇŠš šËõ¡¯õ¯ Ú¡Š šÇŠ Ú´õ°¥, ŠÇŠÎ˜ŠÏ šÇŠš ŠÊšÚ šÇŠõ¯Š Ú´õ°¥ õñ¡ŠÎ˜õ° š¯Š ¿Š° Š°Ú š¯´šÇ ŠÝš õñŠˆ
ÚŠ Úš š¯õç˜ŠÊšÇ šÇŠÈ´šÇš ¡š¥ Ú õýš¥ŠÀ Š°¡ŠÊ.
Š°¡ š¯õ瘚 Šˆˋš š š 2Ú Š¿Š´ šËŠË¥ Ššš¥ŠÀ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠšÇ Š¿ŠÇšÝõ°¥ õ°´õýˋõñ¥š AMPKš š¡š¯Úš Š₤¡š¿Š šÚËš ŠÑšÚŠ õýšÇŠÊ. õñ¡ õý¯õ°¥ ŠÊšõ°¥ õ¯š õý¯ŠÀ š š£šŠÊ.
šý¨šÏ¡, 1šõ¯Ššš ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠ Ú OGTT õý¯õ°¥, Šˆ´Š šÏŠ´šš šš šš Š¿ÚÇ OGTT õ¯ šš šš š šÚõý Šš ÚŠ¿ ššÊš Š°ÇššÏŠÏ, DE šÏŠ´ššŠ OGTT 120ŠÑšÏ¡š šš šš š šÚ š¯´šÇŠË¥ Š°ÇšÇšÏ ššŠÊ. Š¯Š¥š š 2Ú Š¿Š´ šËš ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠš Š¿ŠÇšÝš õ¯š Ú õýš¥ŠÀ Š°Çš¡ŠÊ.
ŠšÏ¡, š 2Ú Š¿Š´ šËŠË¥ Ššš¥ŠÀ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠ šýš¿ŠË¥ Úš Š, õ°´õýˋõñ¥ AMPK ÚšÝÚ ššÊš ŠŠ°ÚÇ šÈ¥Š P-AMPK Š¯Ú š ŠŠË¥ Úõ¯Ú õý¯õ°¥, š š šÇŠ šÏŠ´š š š ÚÇš šÏŠ´š Š¿ÚÇ š šÚõý Šš ššÊš ŠÚŠÇšõ° , Š¿Š´ šÇŠ šÏŠ´š Šˆ´Š šÏŠ´š Š¿ÚÇ š šÚõý Šš ššÊš ŠÚŠš¥ŠÀš´ šÇŠš¥ŠÀ š¡ÚÇ P-AMPK Š¯ÚšÇ šÎõ¯ÚŠ Úšš Š°ÇšŠÊ.
Š¯Š¥š, šÊõ¯Šš š¥ÚšÝ ŠÇŠÎ˜ŠÏ Š˜ŠÎ˜õ¡¯ šÇŠš š 2Ú Š¿Š´ šËš Š¿ŠÇšÝš õ¯š šÚÊõ° , õ°´õýˋõñ¥š AMPK ښݚ šÎõ¯šš¥ Š¿Š´ šÎš õ¯š š õ¡¯š˜ÚŠ õýš¥ŠÀ Úš¡ŠšŠÊ.
Figureô 1.
Blood glucose level to group and time
* significant difference with rest value in NR group
# significant difference with rest value in NE group
$ significant difference with rest value in DR group
@ significant difference with rest value in DE group
Tableô 1.
Blood glucose level to group and time (mg/dl)
| Time | Rest | Post 30min | Post 60min | Post 90min | Post 120min | ||
|---|---|---|---|---|---|---|---|
| Group | |||||||
| NR (n=6) | 58.67ôÝ5.54 | 101.40ôÝ5.26 | 86.47ôÝ9.26 | 77.50ôÝ3.74 | 72.65ôÝ5.25 | Time (F 35.014, P .000)*** | |
| NE (n=6) | 58.17ôÝ4.41 | 119.14ôÝ11.37 | 110.64ôÝ12.85 | 96.37ôÝ14.27 | 94.41ôÝ9.33 | ||
| DR (n=6) | 104.59ôÝ4.89 | 162.67ôÝ23.47 | 178.5ôÝ28.17 | 173.5ôÝ36.67 | 169ôÝ34.50 | ||
| DE (n=6) | 100.33ôÝ6.01 | 181.17ôÝ24.50 | 162.33ôÝ22.46 | 154ôÝ18.99 | 131.67ôÝ22.82 | ||
| Group(F 131.127, P .000)*** | TûG (F 2.198, P .040)* | ||||||
References
1. Ferrannini E. Insulin resistance versus insulin deficiency in non-insulin-dependent diabetes mellitus: Problems and Prospects, Endocr Rev. 1998; 19:477ã490.

2. Schneider SH. Studies on the mechanism or improves glucose control during regular exercise in type ã
À(non-insulin-dependent) diabetes. Diabetologia. 1984; 26:355ã360.

3. Shepherd PR, Kahn BB. Glucose transporters and insulin action - Implications for insulin resistance and diabetes mellitus. N Engl J Med. 1999; 341:248ã257.


4. Kirwan JP, Del Aguila LF, Hernandez JM, et al. Regular exercise enhances insulin activation of IRS-1-associated PI3-kinase in human skeletal muscle. J Appl Physiol. 2000; 88:797ã803.


5. Goodyear LJ, Hirshman MF, Smith RJ, Horton ES. Glucose transporter number, activity and isoform content in plasma membranes of red and white skeletal muscle. Am J Physiol. 1991; 261:E556ãE561.


6. Kawanaka K, Higuchi M, Ohmori H, Shimegi S, Ezaki O, Katsuta S. Muscle contractile activity modulates GLUT4 protein content in the absence of insulin. Horm Metab Res. 1996; 28:75ã80.


7. Host HH, Hansen PA, Nolte LA, Chen MM, Holloszy JO. Rapid reversal of adaptative increases in muscle GLUT-4 and glucose transport capacity after training cessation. J Appl Physiol. 1998; 4:798ã802.
8. Kuo CH, Browning KS, Ivy JL. Regulation of GLUT-4 protein expression and glycogen storage after prolonged exercise. Acta Pysiol Scand. 1999; 165:193ã201.

9. Hardie DG, Hawley SA. AMP-activated protein kinase: an ultrasensitive system for monitoring cellular energy charge hypothesis revisited. Bio Essay. 2001; 23:1112ã1119.
10. Brozinick JT, Etgen GJ, Yaspelkis BB, Ivy JL. Glucose uptake and GLUT-4 protein distribution in skeletal muscle of obese Zucker rat. Am J Physiol. 1994; 267:R236ã243.

11. Gao J, Ren J, Gulve EA, Holloszy JO. Additive effect of contractions and insulin on GLUT-4 translocation into the sarcolemma. J Appl Physiol. 1994; 77:1597ã1601.


12. Winder WW, Hardie DG. AMP-activated protein kinase, a metabolic master switch: possible roles in type 2 diabetes. Am J Physiol. 1999; 277:1ã10.

13. Nicolas M, Nobuharu F, Michael FH, et al. AMP-activated protein kinase (AMPK) is activated in muscle of subjects with type 2 diabetes during exercise. Diabetes. 2001; 50:921ã927.


14. Lanford J, Viese M, Ploung T, Dela F. Time course of GLUT-4 and AMPK protein expression in human skeletal msucle during one month of physical training. Scand J Med Sci Sport. 2003; 13:169ã174.
15. Jessen N, Goodyear LJ. Contraction signaling to glucose transport in skeletal muscle. J Appl Physiol. 2005; 99:330ã337.


16. Del Aguila LF, Krishnan JS, Ulbrecht PA, et al. Muscle damage impairs insulin stimulation of IRS-1, PI 3-kinase, and Akt-kinase in human skeletal muscle. Am J Phyol. 2000; 279:E206ãE212.

17. Kirwan JP, Hickner RC, Yarasheski KE, Kohrt WM, Wiethop BV, Holloszy JO. Eccentric exercise induces transient insulin resistance in healthy individuals J Appl Physiol. 1992; 72:2197ã2202.

18. Asp S, Richter EA. Decreased insulin action in muscle glucose transport after eccentric contractions in rats. J Appl Physiol. 1996; 81:1924ã1928.

19. Kirwan JP, Del Aguila LF. Insulin signalling, exercise and cellular integrity. Biochemical Society Transactions. 2003; 31:1281ã1285.


20. Bedford TG, Tipton CM, Wilson NC, Oppliger RA, Gisolfi CV. Maximum oxygen consumption of rats and its changes with various experimental procedures. J Appl Physiol. 1979; 47(6): 1278ã1283.


21. Armstrong RB, Ogilvie RW, Schwane JA. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol Respirt Environ. 1983; 54(1): 80ã93.

22. Goodyear LJ, Kahn BB. Exercise, glucose transport, and insulin sensitivity. Annu Rev Med. 1998; 49:235ã261.


23. Kennedy JW, Hirshman MF, Gervino EV, et al. Acute exercise induces GLUT-4 translocation in skeletal muscle of normal human subjects and subjects with Type 2 diabetes. Diabetes. 1999; 48:1192ã1197.


24. Yamanouchi T, Kamon J, Waki H, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat Med. 2001; 7(8): 941ã946.


25. Asp S, Daugaard JR, Kristiansen S, Kiens B, Richter EA. Eccentric exercise decreases maximal insulin action in humans: muscle and systemic effects. J Physiol. 1996; 494:891ã898.



26. Zeppetzauer M, Drexel H, Vonbank A, Rein P, Aczel S, Saely CH. Eccentric endurance exercise economically improves metabolic and inflammatory risk factors. Euro J Preven Cardio. 2013; 20(4): 577ã584.

27. Phillippe M, Krusmann PJ, Mersa L, et al. Acute effects of concentric and eccentric exercise on glucose metabolism and interleukin-6 concentration in healthy males. Biol Sport. 2016; 33(2): 153ã158.



28. Hardie DG, Carling D. The AMP-activated protein kinase fuel gauge of the mammalian cell? Eur J Biochem. 1997; 246:259ã273.


29. Winder WW. Energy-sensing and signaling by AMP-activated protein kinase in skeletal muscle. J Appl Physiol. 2001; 91:1017ã1028.


30. Bergeron R, Previs SF, Cline GW, et al. Effect of 5-aminoimidazole -4- carboxamide-1-beta-D-ribofuranoside infusion on in vivo glucose and lipid metabolism in lean and obese Zucker rats. Diabetes. 2001; 50:1076ã1082.








