The Effects of Obesity and Physical Activity on Dyslipidemia in Persons With Type 2 Diabetes
Article information
Abstract
OBJECTIVES
This study was conducted to examine the effect of obesity, and physical activity on the prevalence of dyslipidemia in persons with type 2 diabetes mellitus (T2DM).
METHODS
A cross-sectional, correlational design was used. Participants aged 20 years or older were recruited from a diabetes clinic affiliated with a university hospital. Body composition, blood glucose, glycated hemoglobin, and blood lipid level were measured in addition to self-reported physical activity. Final data analysis was conducted with 177 participants. The differences on physical activity measures and body composition between those with or without dyslipidemia were analyzed using independent t-tests. The associations between dyslipidemia and physical activity and obesity were assessed with the odds Ratio (OR) and 95% confidence intervals (CI) after adjusting potential confounding factors.
RESULTS
The participation rate of regular physical activity in T2DM patients was 55.9%. BMI and regular physical activity participation influenced the prevalence of dyslipidemia in persons with T2DM. The regular physical activity participation rate of T2DM patients without dyslipidemia was higher than that of T2DM patients with dyslipidemia (p<.05). Moreover, participation in regular physical activity decreased the risk of dyslipidemia prevalence (p<.05). With regard to body composition, T2DM patients with dyslipidemia had a higher body mass index (p<.01). As the body mass index 1 increased, odd ratio of the dyslipidemia prevalence increased 1.21 times (p<.05).
CONCLUSIONS
The risk of dyslipidemia in T2DM patients was influenced by BMI and participation in regular physical activity. Therefore, reducing obesity through regular physical activity will be a way to lower the prevalence of dyslipidemia in T2DM.
서론
심혈관질환은 여러 가지 요인의 영향을 받는 질환(multifactorial disease)으로, 주요한 위험요인은 고혈압, 흡연, 이상지질혈증, 당뇨병이다[1]. 이러한 심혈관질환 위험요인 중 고혈압의 유병률은 크게 변동이 없고 흡연율은 유지 혹은 감소하고 있지만, 당뇨병과 이상지질혈증은 지속적으로 증가하고 있는 추세이므로 이에 대한 관리가 요구된다[2-4].
당뇨병과 이상지질혈증은 비만과 관련이 있는 것으로 보고되는데, 비만은 포도당 대사의 교란(perturbation)과 관련되어 2형 당뇨병(type 2 diabetes mellitus, T2DM)의 발병에 기여는 것으로 보고된다. 또한, 비만은 중성지방(triglyceride, TG)의 증가와 고밀도지단백 콜레스테롤(high-density lipoprotein cholesterol, HDL-C)의 기능장애 및 HDL-C의 수준을 감소시키고 저밀도지단백 콜레스테롤(low-density lipoprotein cholesterol, LDL-C)의 수준을 증가시키는 것으로 보고되었다[5].
비만과 함께 신체적 활동의 감소도 제2형 당뇨병의 독립적인 위험인자로 보고된다. 신체적 비활동은 제2형 당뇨병의 진행을 촉진하고 지속적으로 유병률과 사망률을 높이는 요인이 된다[6]. 반면, 신체활동은 체지방량 감소, 지방산화 능력을 증가시켜 중성지방 수준을 감소시키고 고밀도 지단백질의 수준을 증가시키며[7], 조직의 인슐린 감수성을 증가시켜 인슐린 저항성과 요구량을 감소시키고 포도당 운반 및 대사를 촉진하여 혈당을 조절하는 효과가 있다[8]. 또한 신체활동은 근수축을 통한 에너지 소비를 증가시키고 포도당과 지방을 에너지원으로 사용하여 혈당과 지질 수준을 감소시키는 것으로 보고되므로[9], 대사성 질환이 있는 환자의 치료를 위한 비약물적 중재방법으로 흔히 사용된다[10].
T2DM을 가진 사람들은 T2DM가 없는 사람에 비해 TG 수준이 높고 HDL-C 수준이 낮아 혈중 지질수준이 더 좋지 않은 것으로 보고되는데[11], 이는 T2DM 환자들의 대부분이 인슐린 저항성과 인슐린 결핍을 동반하여 근육 세포에 포도당과 중성지방을 저장하는 기능을 저하시켜 혈중 포도당과 지질 수준을 증가시키기 때문으로 제시되었다[12,13].
비만과 T2DM의 관계는 인종에 따라 차이가 있는데, 서구와 비교해서 아시아인들은 상대적으로 마르고 체중과 비만의 정도가 낮음에도 당뇨병으로 발전하는 경우가 많다[15, 16]. 아시아의 비만기준은 체질량지수 25kg/m2 이상으로 서구의 기준보다 낮지만[17], 낮은 체질량지수에도 불구하고 아시아인들은 복부비만과 낮은 근육량을 나타내고 인슐린 저항성이 증가되며, 이러한 현상은 같은 체질량지수 범위 내에서 서구와 비교하여 당뇨병의 위험이 증가하는 것과 관련이 있는 것으로 제시되었다[18-20].
최근의 연구[14]에서는 신체활동 부족이 TG 수준을 증가시키고 HDL-C 수준을 감소시키지만, 비만한 당뇨병 환자의 경우에는 신체활동과 이상지질혈증과의 관련성이 나타나지 않는 것으로 보고하였다. 즉, 당뇨병 환자의 이상지질혈증에 비만이 신체활동보다 더 많은 영향을 주는 것으로 보고하였다. 그러나 선행연구들[21,22]이 이상지질혈증, 당뇨, 비만의 관련성을 단독적인 연관성으로 조사하였기 때문이며, 당뇨병 환자의 이상지질혈증 유병률이 당뇨병에 의한 것인지 신체활동의 부족이나 이에 따른 비만에 의한 것인지에 대한 관련성은 불분명하다. 또한, 성별에 따라 여성은 50-55세부터 이상 지질혈증의 유병률이 증가하는 반면, 남성은 40-70세에 유병률이 증가하지 않거나 오히려 감소하는 경향을 나타내어 성별에 따른 차이도 있는 것으로 보고하였으나 대부분의 연구들이 성별에 따른 구분이나 영향력을 살펴보지 않았다[23]. 이에 이 연구에서는 T2DM 환자를 대상으로 나이, 성별, 비만수준과 신체활동 참여 및 빈도가 이상지질혈증의 유병률에 미치는 영향을 분석하고자 실시되었다.
연구방법
1. 연구 대상
이 연구는 C 대학병원의 내분비내과 외래를 방문하는 T2DM를 가지고 있는 20세 이상의 성인이었다. 제외 조건은 (1) 치매와 같은 인지장애로 인해 의사소통이 불가능한 자, (2) 시각이나 청각 등의 장애로 읽고 듣는 것이 불가능한 자, (3) 한국어 의사소통이 어려운 자이다. 대상자 수 계산은 G*power 3.0.10 software를 이용하였다. 파워분석 조건은 ANOVA(Fixed effects, Omnibus, One-way) Cohen’s f=.25 (medium effect), alpha=.05, 즉, power-.80을 사용하였으며, 총 159 명의 대상자가 필요함으로, 약 20%의 탈락율을 고려한 191명을 모집하였다. 자료를 수집 전에 IRB 승인을 받아 연구를 진행하였으며(201910-SB-184-01), 모든 검사와 설문지까지 완료한 최종 인원 177명에 대한 자료를 분석하였다.
2. 연구절차
1) 신체구성 측정
신장, 체중, 근육량 및 허리/엉덩이둘레 비(waist per hip ratio, WHR)는 가벼운 옷차림을 한 상태에서 신발을 벗고 직립한 자세로 체성분분석기(Inbody 4.5, Biospace, Republic of Korea)를 사용하여 생체전기저항법(Bioelectrical impedance analysis)으로 측정하였다. 신장은 0.1cm 단위까지 측정하였고, 체중은 0.1kg 단위까지 측정하였다. 또한, 신장과 체중을 이용하여 체질량지수(BMI)는 체중(kg)/신장(m2)의 계산법에 따라 계산하였다.
2) 신체활동 측정
신체활동의 추정하기 위해 국제합의기구에서 개발된 신체활동설문지(International Physical Activity Questionnaire, IPAQ)를 사용하였다. IPAQ는 여가시간, 실내 활동, 야외활동, 일 관련, 교통관련 활동 등을 모두 포함하는 포괄적인 범위에서 행해지는 모든 신체활동을 측정하며, 지난 7일 동안 시행한 10분 이상의 고강도(>6METs), 중강도(3~6METs) 활동 및 걷기(<3METs) 시간을 평균 시간과 빈도를 작성하도록 되어 있다[24]. 이 설문지는 2000년에 12개국에서 신뢰도와 타당도 조사가 이루어졌으며[25], 장문형, 단문형 자기기입식 설문지와 전화를 통한 설문 방식으로 나누어진다[26]. 이 연구에서는 자기기입식 설문방식을 이용하여 조사된 신체활동량을 바탕으로 중강도의 신체활동이나 고강도의 신체활동을 주당 30분 이상하는 실시하는 경우를 규칙적인 신체활동에 참여하는 집단으로, 그 외에는 참여하지 않는 집단으로 분류하였다.
3) 혈중 포도당과 지질 수준 측정
혈액검사 결과는 자료수집일로부터 1개월 내외의 임상자료의 결과를 연구참여자의 동의를 얻은 후 병원 데이터베이스에 저장된 결과를 차트 리뷰를 이용하여 수집하였다. 모든 대상자들은 최소한 12시간 이상의 금식을 한 후 병원 외래를 방문하여 정맥혈을 채취하도록 교육되었다.
4) 이상지질혈증 유병률 조사
이상지질혈증은 National Cholesterol Education Program Adult Panel III(NCEP-ATP III)에서 권고하는 고콜레스테롤혈증(LDL-C ≥100 mg/dL), 고중성지방혈증(TG ≥150 mg/dL), 또는 저고밀도지단백콜레스테롤혈증(HDL-C <40 mg/dL)인 경우, 또는 과거 의사진단을 받았거나 지질강하제를 복용하는 경우로 정의하였다[27].
3. 자료처리방법
모든 통계 분석은 SAS 소프트웨어(버전 9.4; SAS Institute Inc., Cary, NC, USA)를 사용하여 측정항목들에 대한 평균과 표준편차를 산출하였다. 당뇨병 환자의 성별에 따른 신체구성, 당화혈색소, 공복 시 혈당, 혈중 지질 수준의 차이는 독립검정(independent t-test)를 이용하여 분석하였다. 이상지질혈증 유무에 따른 신체구성의 차이는 독립검정을 이용하여 분석하였으며, 신체활동 참여빈도의 차이는 교차분석(chi-square test)을 이용하여 분석하였다. 나이, 성별, 비만수준, 규칙적 신체활동 참여와 빈도가 이상지질혈증 유병률에 미치는 영향을 알아보고자 Model 1은 나이와 성별로, Model 2는 BMI, SMM, WH로, Model 3은 규칙적 신체활동 참여와 빈도를 변수로 하는 위계적 로지스틱 회귀분석(hierarchical logistic regression)을 실시하여 이상지질혈증 발병에 대한 승산비(odds ratios, OR)와 95% 신뢰구간(confidence intervals, CI)을 계산하였다. 통계적 검정은 양측 검정을 사용하였으며, 모든 유의수준은 α=.05에서 검증하였다.
결과
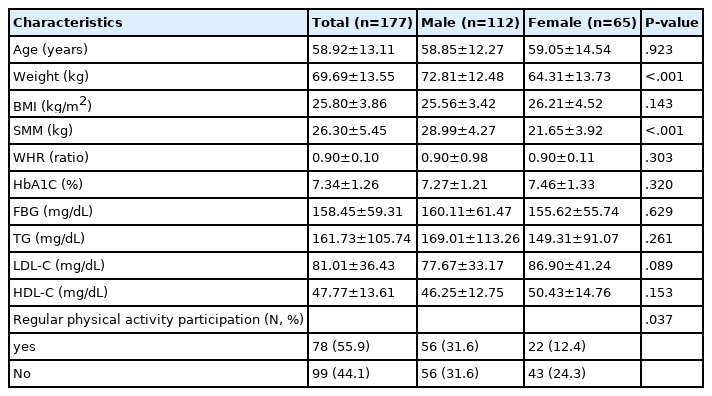
성별에 따른 T2DM 환자의 임상적 특성의 차이는 <Table 1>과 같다. 신체구성 요인 중 체중, 근육량에서 유의한 차이가 나타났으며(p<.001), 신체활동 참여율에서 유의한 차이가 나타났다(p<.05).
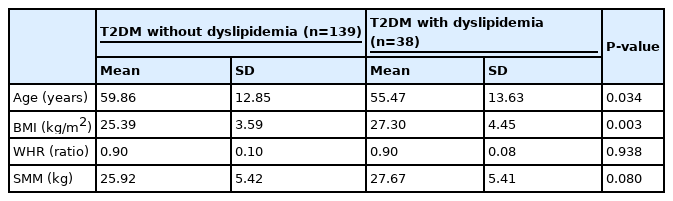
이상지질혈증 유무에 따른 T2DM 환자와 대상자들의 나이와 신체구성에 따른 차이는 <Table 2>와 같다. 이상지질혈증을 가진 T2DM 환자들은 이상지질혈증이 없는 T2DM 환자들보다 나이가 적은 것으로 나타냈으며(p<.05), 체질량지수는 유의하게 높은 것으로 나타났다(p<.01).
이상지질혈증 유무에 따른 T2DM 환자와 대상자들의 신체활동 수준은 <Table 3>와 같다. 신체활동 참여율은 이상지질혈증을 가진 T2DM 환자들이 전체 T2DM 환자보다 낮은 경향을 나타냈다(p=.053).
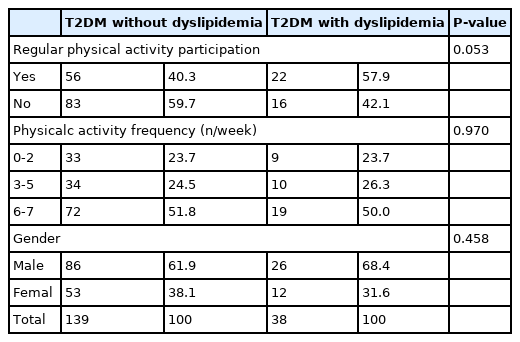
The prevalence of dyspilidemia according to physical activity between T2D patients with or without dyslipidemia
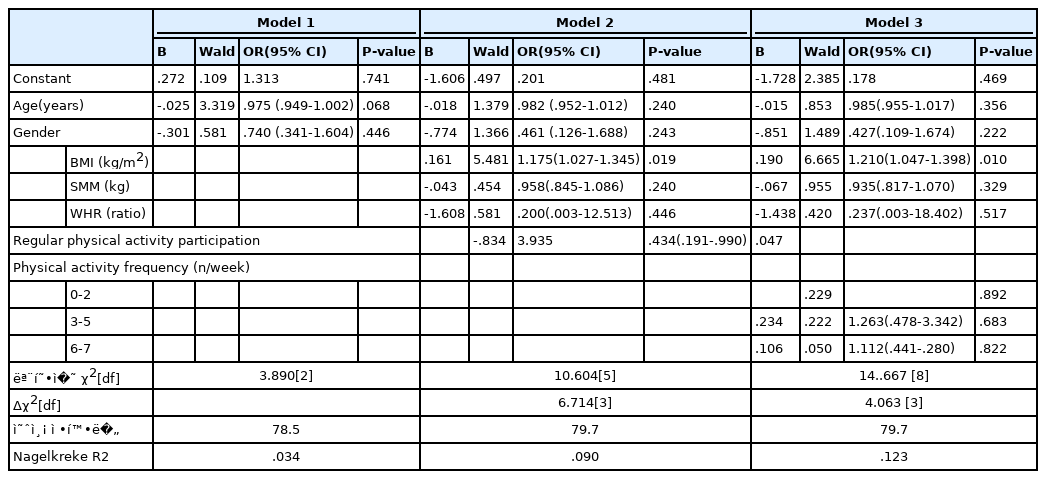
T2DM 환자의 나이, 성별, 비만수준, 신체활동 참여와 빈도가 이상지질혈증의 유병률에 미치는 영향을 분석한 결과는 <Table 4>와 같다. BMI가 이상지질혈증의 발병에 유의한 영향을 미치는 것으로 나타났으며, BMI가 1 증가할 때마다 승산비가 1.21배 높아지는 것으로 나타났다(p<.05). 신체활동 참여도 이상지질혈증의 발병에 유의한 영향을 미치는 것으로 나타났으며(p<.05), 신체활동에 참여하는 T2DM 환자는 신체활동에 참여하지 않는 T2DM 환자보다 이상지질혈증 발병 승산비가 .434배 낮춰지는 것으로 나타났다.
논의
T2DM 환자의 비만과 신체활동 참여가 이상지질혈증 유병률에 미치는 영향을 분석한 연구의 결과 전체 T2DM 환자 중 이상지질혈증이 없는 T2DM 환자들은 신체활동 참여율은 31.6%로 나타났으나, 이상지질혈증을 가진 T2DM 환자의 신체활동 참여율은 12.4%로 낮은 신체활동 참여율 경향을 나타냈다(p=.053). 반면, 신체활동에 참여했을 때 는 이상지질혈증 유병률의 승산비(OR)는 .434로 낮아졌다.(p<.05). 연령은 이상지질혈증을 가진 T2DM 환자가 더 낮은 것으로 나타났으며(p<.05), BMI는 더 높은 것으로 나타났으며(p<.05), BMI가 1 증가할 수록 이상지질혈증의 승산비는1.211배 증가하는 것으로 나타났다(p<.05).
이 연구에서 연령은 성별에 따른 차이가 없었다. 체중과 근육량은 남성이 여성보다 유의하게 높은 것으로 나타났으나(p<.01), BMI의 차이가 나타나지 않았고, 이에 따라 이상지질혈증의 유병률에 나이와 성별은 유의한 영향을 주지 않는 것으로 나타났다. 이러한 결과는 성별에 따른 이상지질혈증의 유병률 차이가 나이가 증가함에 따라 여성은 증가하고 남성은 유지 또는 감소하여 유병률이 교차되는데[23], 이 연구에서 성별에 따른 나이 차이가 나타나지 않았기 때문으로 생각된다.
이상지질혈증을 가진 T2DM 환자의 나이는 55.47±13.65세로 이상지질혈증이 없는 T2DM 환자들의 59.86±12.85세보다 유의하게 낮은 것으로 나타났다(p<.05). 이러한 결과는 2014년부터 2018년 국민건강영양조사 자료를 바탕으로 나이별 이상지질혈증의 유병률을 조사한 결과 40세 이하에서 88.6%의 이상지질혈증이 발병하였다는 선행연구의 보고와 일치하는 결과였다[28]. 따라서 T2DM 환자에게 이상지질혈증이 일찍 발병하고 이상지질혈증은 심혈관질환 등 당뇨병 합병증의 원인이 되므로[29] 초기의 관리가 중요할 것으로 생각된다.
또한, 이 연구에 참여한 T2DM 환자들의 BMI는 약 25.80±3.86 kg/m2으로 아시아인의 비만 기준 수준이었으나 이상지질혈증을 가진 T2DM 환자의 BMI는 약 27.30±4.45 kg/m2으로 더 높은 수준을 나타냈으며(p<.05), BMI가 1 증가할 때마다 이상지질혈증 발병의 상대적 위험도가 1.210 배(95% CI: 1.047-1.398) 높아지는 것으로 나타났다(p<.05). 한국인을 대상으로 한 선행연구[28]에서도 BMI가 높은 경우 이상지질혈증의 발병 위험도가 1.27배(95% CI: 1.13-1.42) 높아지는 것으로 보고하였으며, 이는 T2DM 환자에게 비만도는 이상지질혈증의 유병률을 증가시키는 위험요인임을 확인할 수 있는 결과였다.
비만에 의한 이상지질혈증의 특징은 초저밀도 지단백 콜레스테롤(very low-density lipoprotein cholesterol, VLDL-C)의 증가와 HDL-C의 감소 및 공복과 식후 TG의 증가이다. 비만은 지방조직에서 지단백질 분해효소(lipoprotein lipase)의 mRNA 발현 수준과 골격근에서의 LPL 활성을 감소시키며, VLDL과 킬로미크론(Chylomicron, CM) 사이의 지방분해 경쟁에 의해 TG가 풍부한 지단백질의 지방분해가 지연되게된다. TG가 풍부한 지단백질 제거 지연은 고중성지방혈증으로 이어지기 때문에 다른 지질 이상의 주요한 원인이 될 수 있다[29]. 따라서 비만은 혈중 지질의 대사에 문제를 일으키고 혈중 지질 수준이 높아지는 원인이 되므로 2형 당뇨병 환자들의 이상지질혈증 유병률을 낮추기 위해서는 체중감량과 같은 비만도를 낮추기 위한 노력이 이루어져야 할 것으로 생각된다.
또한, 복부 또는 내장 비만은 전신염증, 이상지질혈증, 인슐린저항성과 관련이 있으며, 높은 BMI가 복부 비만의 주요원인으로 작용하는 것이 아니라 과도한 내장 지방의 축적이 BMI와 상관없이 대사적 문제를 야기하는 것으로 보고되었다[30]. 이 연구의 T2DM 환자의 WHR은 약 0.90±0.10로 BMI와 마찬가지로 복부비만의 기준 수준을 나타냈으나, 이상지질혈증을 가진 T2DM 환자의 WHR도 유사한 수준을 나타냈다. 그러나 이 연구에서 WHR 수준은 BMI와 달리 이상지질혈증의 발병 위험도는 유의한 수준을 나타내지 않아 선행연구와 다른 결과를 나타내었고, 이러한 결과는 허리둘레가 아닌 신체구성 기기에서 측정된 WHR을 사용하였기 때문에 복부비만 수준에 대한 오차의 가능성과 이상지질혈증을 가진 2형 당뇨병 환자와 이상지질혈증이 없는 2형 당뇨병 환자의 WHR 차이가 없었던 결과가 영향을 주었을 것으로 생각되며, 이와 관련된 추가적인 연구가 필요할 것으로 생각된다.
신체활동 부족과 비만은 이상지질혈증 위험을 초래할 수 있으며, 특히 비만한 사람의 신체활동 부족은 TG 수준의 증가, HDL-C 수준의 감소와 관련이 있어 신체활동과 비만의 단독적인 영향보다 병행되어 나타날 때 혈중 지질 수준을 더 악화시키는 것으로 보고되었다[31]. 반면, 규칙적인 신체활동은 체중감소를 통해 이상지질혈증의 발병 위험을 감소시킬 수 있으며[32], 신체활동으로 인한 지질 수준의 변화에 대한 기전은 아직까지 불분명하지만 체중감소 및 CM과 지단백질의 중성지방을 분해하는 지단백질 리파제(lipoprotein lipase)의 활성을 증가시켜 지질의 에너지원 동원을 높여 지질 수준을 감소시키는 것으로 제시되었다[33, 34]. 또한, Saltin & Helge [35]의 연구에서는 신체활동이 지질 전환을 위한 효소를 활성화시켜 조직의 글리코겐 대신 지방을 더 잘 연소시키도록 근육의 능력을 증가시킨다고 하였고 Norregaard et al [36]은 6주간의 신체활동 훈련이 LDL-C 수준을 감소시켰다고 보고하였다.
그러나 신체활동 참여자와 비신체활동 대상자 간에 TC와 LDL-C의 수준 차이가 없다는 보고[37,38] 및 고강도/고운동량의 신체활동이 LDL-C 입자의 크기를 증가시킨다는 보고[36]도 있어 신체활동과 혈중 지질수준의 관계는 아직도 불분명하다. 특히 비만한 T2DM 환자는 신체활동과 혈중 지질수준의 관련성이 부족한 것으로 보고되며[14], 운동중재에 따른 비만인의 포도당 조절 및 인슐린 작용의 변화는 체중감량이 동반되지 않는 경우 나타나지 않는다고 하므로[39,40] 당뇨병 환자의 이상지질혈증 유병률은 신체활동 수준만으로는 설명하기에 부족함이 있다. 이 연구에서는 이상지질혈증이 없는 T2DM 환자의 신체활동 참여율이 이상지질혈증 가진 T2DM 환자보다 높은 경향을 나타냈고(p=.053) 규칙적인 신체활동에 참여하는 경우 이상지질혈증 유병률의 승산비 (OR).434배(.191-.990)로 낮춰지는 것으로 나타나선행연구들[32, 35, 36]과 유사한 결과를 나타냈다. 하지만 신체활동이 이상지질혈증에 영향을 주지 못한다는 연구들[14, 39, 41]도 존재하는데, 인슐린 저항성 또는 결핍, 아디포사이토카인 및 고혈당증은 T2DM 발병 이전에도 나타나기 때문에 혈중 지질수준과 이상지질혈증의 발병에 영향을 미친다고 한다. [42] 따라서, 당뇨병 환자를 대상으로 하는 더 많은 추가적인 연구가 이루어져야 할 것으로 생각된다.
결론
이 연구에서 T2DM 환자들의 이상지질혈증 발병의 상대적 위험도는 BMI로 제시된 비만과 신체활동의 참여가 영향을 주는 것으로 나타났다. 따라서 비만이 이상지질혈증에 영향을 주지만 신체활동이 이러한 비만에 의한 영향을 상쇄할 수 있는 것으로 나타났으므로, T2DM 환자들의 혈중 지질을 조절하고 이상지질혈증 유병률을 낮추기 위해서는 규칙적인 신체활동을 통한 비만 감소가 이루어져야 할 것으로 제시하는 바이다. 또한 T2DM 환자들의 이상지질혈증 유병률과 관련하여 더 많은 환자들을 대상으로 한 추후 연구를 통해 이러한 결과를 확인할 수 있는 연구가 필요할 것으로 생각된다.
Acknowledgements
이 연구는 2019년도 한국연구재단의 지원을 받아 수행된 연구임 (NRF-2019R1A2C1087199; PI: Cha, E.S).
Notes
The authors declare no conflict of interest.